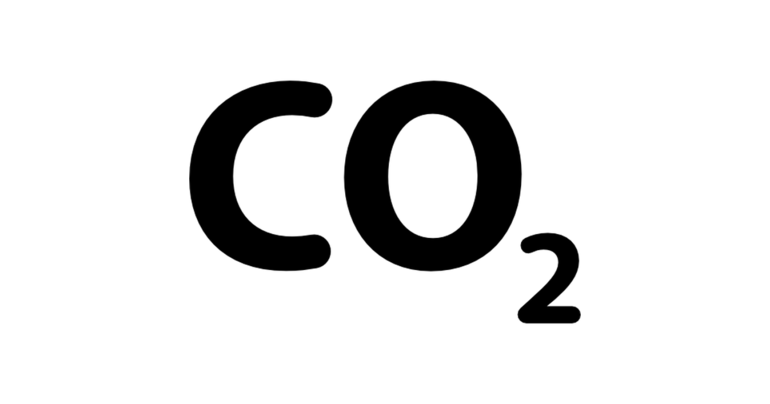Содержание
Люди постоянно находятся под влиянием различных газообразных веществ: воздух, которым дышит человек — это тоже смесь газов, а не чистый кислород, как думают некоторые — в нее входят азот и диоксид углерода. Основные свойства веществ, входящих в состав атмосферы изучают на уроках химии в 8 классе (формулы: углекислый газ — CO2, азот — N, кислород — O2).
Основные характеристики
Диоксид углерода был открыт в XVII веке французским ученым по фамилии Гельмонт. Тогда же была установлена и химическая формула этого углеродного соединения. Однако его подробное описание «появилось» лишь спустя век, было оно сделано по результатам исследований, проведенных Джозефом Блэком (Шотландия). Именно он установил, что углекислота выделяется при дыхании животных. При нормальных условиях CO2 обладает такими свойствами:
- Бесцветность.
- Отсутствие выраженного запаха (только при повышенной концентрации газа в помещении человек способен ощутить некоторую «кислинку» как привкус).
- Хорошая растворимость в воде, а результатом реакции становится образование слабой кислоты: CO2 + H2O ↔ H2CO3.
Двуокись углерода в полтора раза тяжелее воздуха (можно «переливать» из сосуда в сосуд). Молярная масса равна 44 г/моль. Молекулярное строение — линейное (O=C=O). Плотность углекислого газа равна 1,913 кг/м3 при нормальных условиях. При давлении 69 атм и комнатной температуре он сжижается.
Примечание: если попытаться вылить жидкий диоксид углерода из сосуда, большая часть его молекул испарится. При этом будет расходоваться значительное количество тепла и часть углекислоты затвердеет, образуя снегообразное вещество — сухой лед.
Этот газ не поддерживает горения (если в сосуд, заполненный CO2, опустить зажжённую спичку, она моментально потухнет). Он непригоден для дыхания:
- 3% концентрация в воздухе станет причиной учащенного дыхания у человека;
- 10%-я концентрация вызовет потерю сознания и станет причиной летального исхода;
- 20%-ное содержание в воздухе приводит к мгновенному параличу.
Однако природе без этого газа не обойтись — именно им насыщаются растения, превращая его затем в органические вещества. То есть углекислый газ участвует в метаболических процессах живых клеток.
Что касается химических свойств, CO2 относится к кислотным оксидам. Он взаимодействует со щелочами, а конечными продуктами являются карбонаты и гидрокарбонаты:
- Ca (OH)2 + CO2 → CaCO3 (осадок) + H2O;
- KOH + CO2 → KHCO3.
При взаимодействии с водой СО2 образует слабостойкую угольную кислоту, которая может существовать только в виде разбавленного раствора. При нагревании она частично разлагается, а при кипячении полностью распадается.
Получение и применение
Источники природного нахождения двуокиси углерода — разнообразные окислительные процессы. Например, дыхание людей, животных. Другие варианты:
- Вулканическая активность — при извержениях CO2 выбрасывается из глубинных слоев мантии Земли вместе с другими газообразными веществами. Известны случаи, когда люди, проживающие вблизи «дышащих» вулканов (особенно если их жилища располагались в низинах), массово страдали от удушья.
- Процессы горения или гниения органических веществ — по сути, эти реакции идентичны, отличаются только скоростью протекания.
- Воды мирового океана — самый крупный «поставщик» природного углекислого газа.
Но источниками CO2 в атмосфере могут служить не только природные ресурсы. Промышленные выбросы, выхлопные газы авто — все это становится причинами попадания диоксида углерода в окружающую среду. А еще на увеличение концентрации этого вещества влияет и безалаберное отношение человека к природе: вырубка лесов, стихийные свалки.
Производственное и лабораторное извлечение вещества
В лабораторных условиях диоксид углерода получают при взаимодействии карбоната кальция и соляной кислоты (серная кислота в этом случае не годится):
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
Реакцию проводят в аппарате Киппа (специальный прибор для получения газов).
В промышленности для получения CO2 используют реакцию термического разложения:
CaCO3 → CaO + CO2.
В качестве исходного материала применяют известняк, мел, реже — доломит, магнезит. Кроме того, газ получают и при сжигании угля, торфа, нефтепродуктов и древесины. Еще один вариант — извлечение из отходов, образующихся на химических производствах. Именно такой метод является наиболее рентабельным с экономической точки зрения.
Высококачественный диоксид углерода получают во время протекания реакций брожения (например, при производстве алкогольсодержащих напитков). Здесь углекислый газ обрабатывают марганцовкой, углем и водородом. Итогом всех этих манипуляций становится жидкая углекислота.
Примечание: «сухой лед» — побочный продукт пищевой отрасли (пивоварение, ликероводочная промышленность).
Использование двуокиси углерода
Углекислый газ широко применяется в различных отраслях промышленности. Например, он незаменим в содовом производстве, синтезе органических кислот, изготовлении безалкогольных «шипучих» напитков (ситро, лимонада и прочих). Сухой лед используется в качестве охлаждающего компонента — холодная среда препятствует гниению пищевых продуктов. Другие варианты:
- В металлургической промышленности — для регулировки процесса отвода стоков, осаждения газов, использование лазерного луча, сварка.
- Химическая промышленность — регулирование скорости проведения химических реакций, в качестве нейтрализатора щелочи, очистки тканей.
- Легкая промышленность — целлюлозно-бумажное производство.
- Медицина и фармацевтическая промышленность — углекислота незаменима при проведении некоторых хирургических вмешательств, реанимировании пациентов.
А еще углекислый газ используют в сельском хозяйстве при выращивании различных культур: в качестве «подкормки» его запускают в зимние теплицы для улучшения «дыхания» растений. Кроме того, двуокись углерода используется и при тушении пожаров, особенно тех, что невозможно ликвидировать порошковыми или пенными средствами.