Содержание
Диеновые углеводороды имеют 2 двойных связи в молекулах. Физические и химические свойства алкадиенов (это другое их название) обусловлены строением, а именно наличием сопряженной системы, создаваемой молекулами. Во многом они похожи на алкены и так же способны вступать в реакции присоединения и окисления.
Номенклатура и изомерия
Обозначения формируются путем добавления «диен» и числа к исходному алкану. Так, пишут пропадиен, бутадиен. Составляя наименование, важно помнить, что в главной цепи должны содержаться несколько двойных связей. Ее длина зависит от их количества.
Нумерация начинается с того края, к какому они расположены ближе.
Для такого класса веществ характерны несколько видов изомерий. Среди них принято выделять:
- С алкинами — как пример можно привести гексадиен-2,4.
- Углеродного скелета (пентадиен-1,3 или 2-метилбутадиен-1,3).
- Геометрическую в виде трансизомеров. Она обусловлена различием взаимного расположения в пространстве заместителей относительно плоскости, вокруг которой невозможно внутримолекулярное вращение.
С точки зрения химии, первые две разновидности принято считать структурными. Третья называется пространственной.
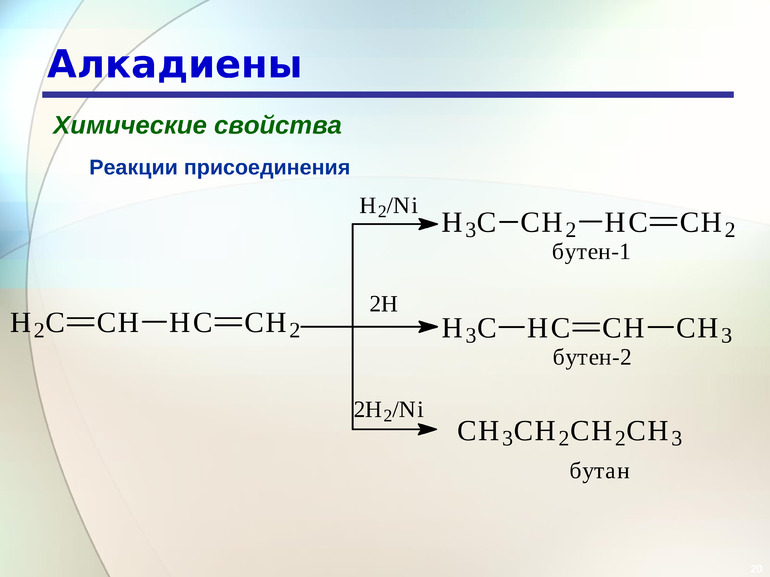
Химические свойства
Рассматриваемые соединения обладают способностью к гидрированию. Оно происходит под воздействием металлических катализаторов. А также требуется давление и нагревание. Могут они вступать и в следующие качественные реакции:
- Галогенирование (замещение) происходит при комнатной температуре. Для него необходим растворитель. В его роли часто выступает вода. При взаимодействии с бромом (одним из галогенов) дивинила вырабатывается 1,2,3,4-тетрабромбутан. Это называется бромирование.
- Гидрогалогенирование — добавление галогеноводородов. Например, в случае присоединения хлорводорода к бутадиену-1,3, как, правило образуется 1-хлорбутен-2 (в небольшом количестве).
- Под полимеризацией понимается многократное окисление молекул мономера. В результате получается высокомолекулярное вещество (полимер). Бутадиен в итоге превращается в искусственный каучук, а изопрен — в природный.
Возможно и окисление. Оно сопровождается увеличением исходного числа атомов кислорода. Содержание водорода значительно уменьшается. Такой процесс подразделяют на жесткий (под действием перманганатов) и мягкий (при низкой температуре).
Свойственно диенам и разложение. Таким образом метан преобразуется в сажу и H2.
Для горения необходимо присутствие O2. С его помощь получают углекислый газ и воду.
Гидратация происходит не у всех алкадиенов. Сетчатая подгруппа не вступает в такую реакцию.
Физические особенности
Низшие члены ряда гомологов (метан, гексан, этан, гептан, пропан, октан) являются газообразными веществами. У них низкая температура кипения и плавления. В случае увеличения молекулярной массы эти показатели становятся больше, а вещество переходит в жидкое состояние.
Рассматриваемые соединения нерастворимы в воде, но хорошо растворяются в органических растворителях (в бензоле, спирте). Температурные особенности указаны в таблице.
| Название | t закипания | При какой t плавится |
| Пропадиен | -136,1 | -34,5 |
| Бутадиен-1,2 | -136,2 | +10,8 |
| 2-метилбутадиен-1,3 | -146 | +34,1 |
| Пентадиен-1,3 | -87,5 | +42 |
| Гексадиен-1,5 | -140,7 | +59,5 |
| 2,5-диметилгексадиен-2,4 | +14,8 | +134,5 |
Способы получения и использование
В промышленности бутадиен-1,3 можно выработать путем каталического дегидрирования 2-метилбутана, выделяемого из фракции нефтеперегонки. Еще один метод — добавление этилового спирта. Лабораторный вариант — реакция отщепления.
Область применения алкадиенов обширна. Наиболее распространенная — создание синтетического каучука. Углеводороды, в которых содержится более двух двойных связей, называются т
ерпенами. Они распространены в растительных организмах. Из них производят духи.
Диен под названием каротин, превращающийся в организме в витамин А, содержится в красных и желтых плодах. Он считается жизненно необходимым для человеческого организма.
Ацитилен может использоваться, когда требуется высокотемпературное пламя в процессе газовой сварки. Получают из него и растворители. Например, если присоединять к нему хлор, образуется тетрахлорэтан.
Отличительная черта диенов — наличие двух двойных связей в молекуле. Способы использования и получения алкадиенов, их физические и химические свойства обусловлены этой особенностью.