Получение аммиака происходит различными методами. Этот процесс осуществляется как в лаборатории, так и на промышленном производстве. Легковесный газ с резким запахом состоит из азота и водорода. Чаще всего он используется для изготовления удобрений, полимеров и некоторых кислот.
История получения
Аммиак известен с давних времен. По сведениям ученых, свое название он получил в честь бога Амона, которого почитали в Древнем Египте. Образовывался газ в результате разложения мочевины в жарком климате. Резкий запах соединения египтяне связывали с культом божества.
В чистой форме аммиак H2+N2=NH3+Q получил известный ученый Джозеф Луи Пристли. В своей лаборатории он нагревал хлорид аммония с гашеной известью. Такая схема до сих пор используется, если нужно получить на выходе небольшое количество газа. Полученный аммиак Пристли собирал надо ртутью. Раствор в водной основе имеет признаки щелочи.
В 1784 году французский химик Бертолле разложил аммиак на элементный состав. Спустя 3 года было утверждено официальное название «нашатырь». Оно сохраняется до сих пор в ряде западноевропейских языков.
Промышленный метод
Получение аммиака в промышленности происходит на основе азота, который соединяют с водородом. Последний берут из воды, азот набирают в воздухе. Метод разработал Фриц Габер. Сейчас процесс получения аммиака в производстве носит имя этого ученого.
Реакция 3H2+N2=2NH3+Q происходит при понижении объема и выходе тепла. Поскольку она обратима, то необходимо соблюдать некоторые условия. Высокое давление и небольшие температуры способствуют повышению объема полученного аммиака, при этом происходит замедление процессов. Благодаря сохранившимся описаниям первых опытов удалось обеспечить необходимые параметры для создания реакций:
- Температура должна достичь 500 °C.
- Давление — 350 атмосфер.
- В качестве катализатора выступает оксид железа (магнетит). К нему добавляют части оксида серебра, кальция и других веществ.
Газ, который удалось сделать в таких условиях, имеет 30% аммиака. Чтобы избежать обратной реакции, вещество требуется охладить, тогда оно превратится в жидкость. В то же время не до конца израсходованные газы будут возвращены в синтез. Тогда можно собрать аммиак в большом количестве с возможностью максимального использования полученного сырья.
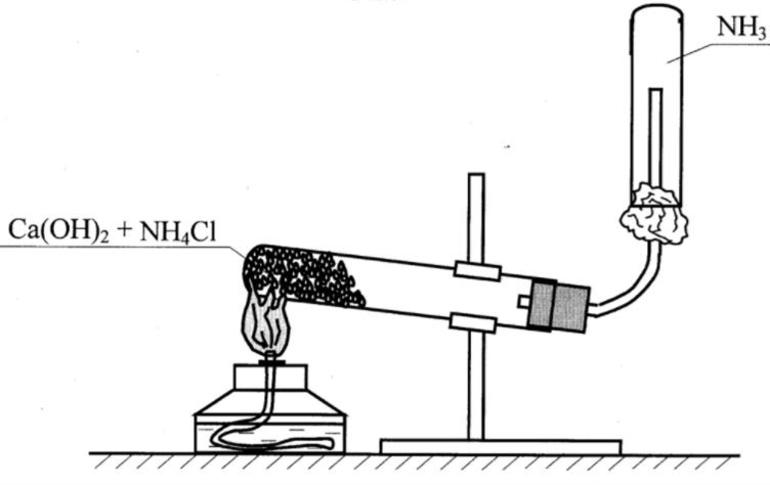
Лабораторный способ
Лабораторный способ получения вещества обеспечивается благодаря действию щелочи на твердые соли аммония. Для этого используют формулу 2NH4Cl+CaOH2=2NH3+2H2O+c=CaCl2. Собирание проводят в перевернутую пробирку из-за воздуха, так как он легче по плотности. Распознавание происходит следующими методами:
- по запаху;
- лакмусовая бумажка окрасится в синий цвет;
- от поднесенной стеклянной палочки, смоченной в HCl, будет идти дым белого цвета.
Полностью осушить газ можно смесью извести и едкого натрия. Через нее пропустят получившуюся реакцию. С аналогичной целью жидкий аммиак перемешивается с металлическим натрием, после чего подвергается дистилляции. Благодаря этому будет легче распознать газ.
Химические свойства
Газ представляет собой довольно реакционное вещество. В таком виде NH3 окисляется. Продукт окисления будет зависеть как от силы окислителя, так и от условий проведения реакции. Например, 8NH3+3Cl2=N2+6NH4Cl или 2NH3+2Na=2NaNH2+H2.
Водный раствор обычно называют нашатырным спиртом. При этом его не относят к соответствующей группе, так как это неорганическое соединение. У химиков такой продукт называют гидроксидом аммония.
Также NH3 относится к лигандам в комплексных соединениях. Его молекулы образовывают донорные связи как с водородом, так и с частью переходных металлов в виде меди или кобальта. Это приведет к появлению растворимых химикатов. Они применяются в качестве реактивов для качественного анализа.
NH3 можно получить различными методами, которые описываются соответствующими уравнениями. В промышленных масштабах газ получают смешиванием азота и водорода. Благодаря своим свойствам его можно применять как на производстве, так и в лабораториях и рабочих условиях.