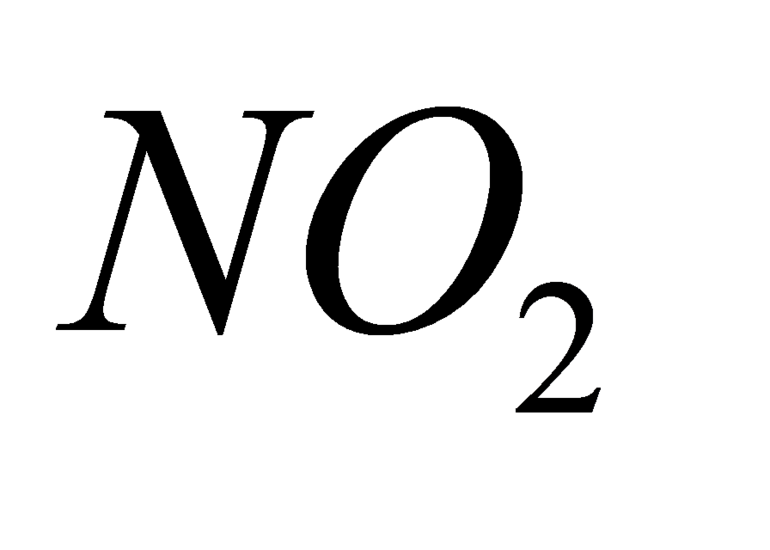Содержание
Азот находится в V подгруппе периодической системы Менделеева. В природе этот элемент существует в виде простого газа, встречается в свободном состоянии в воздухе (70−80% по объему), входит в состав сложных органических веществ (пептиды, белки). Оксиды азота (формула вещества будет зависеть от валентности) — бинарные соединения с кислородом.
Виды кислородных соединений азота
Всего известно 10 разновидностей оксидов азота. Однако «классических» всего 5. Среди них:
- N2O — закись азота.
- NO — монооксид (окись) азота.
- N2O3 — азотистый ангидрид.
- NO2 — диоксид азота.
- N2O5 — азотный ангидрид.
Первые две формулы — несолеобразующие соединения, оставшиеся три относятся к солеобразующим веществам. Все оксиды этого неметалла ядовиты. Исключение — N2O, который обладает слабым наркотическим действием и применяется медиками в качестве наркозного средства.
Закись азота — «веселящий газ» — раньше использовалась при родовспоможении в качестве анальгетика, хотя и довольно слабого. Главное преимущество такого наркоза состоит в том, что он не оказывает негативного токсического влияния на молодую мать и малыша: попадая в организм, газ распадается на «привычные» человеку азот и кислород.
Другие соединения — димер диоксида азота (сложная молекула, состоящая из двух мономолекул) с формулой N2O4, нитритный радикал NO3, и три малоустойчивых комбинации: NON3, NO2N3, N (NO2)3.
Описание и характеристики
Физические и химические свойства каждого подвида оксидов этой группы различны. Например, несолеобразующие соединения (закись и оксид азота 2-валентный) не вступают в реакции с кислотами, щелочами и водой. А солеобразующие взаимодействуют с этими соединениями, причем каждому из них соответствует определенная кислота. Например:
- N2O3 — азотистая (HNO2) — нестойкое соединение, ее растворы окрашены в нежно-голубой цвет.
- N2O — азотная (HNO3) — очень сильная кислота.
«Царская водка» — раствор азотной и соляной кислоты (а не серной и соляной, как заблуждаются некоторые люди) в соотношении 1:3. Это одна из наиболее сильных кислотных смесей, способных растворить даже инертное золото. Поэтому сотрудники лабораторий, работая с этим веществом даже в перчатках, всегда снимают все ювелирные изделия с рук.
N2O — одновалентная смесь
При нормальных условиях — это газ, не имеющий цвета и запаха. При снижении температуры он меняет свое агрегатное состояние:
- При -89°C он становится жидким.
- При -91°C — затвердевает.
Соединение не отличается высокой устойчивостью — разлагается на кислород и азот:
2N2O → 2N2 + O2.
Эта смесь значительно богаче по содержанию кислорода, чем обычный воздух, поэтому вещества, попадающие в нее, горят. Например, если поместить в сосуд, заполненный этим соединением, тлеющую лучину, то она сразу же вспыхнет. Гемиоксид получают путем термического разложения аммонийной селитры:
NH4NO3 → N2O + 2H2O.
Эта реакция протекает спокойно до 300 °C. При повышении температуры может произойти взрыв.
N2O оказывает возбуждающее действие на нервную систему: при вдыхании происходит легкое «опьянение» и повышается сонливость. Одновременно с этим притупляются и болевые ощущения.
Монооксид (двухвалентный) — NO
Бесцветный газ. Имеет слабый запах, при вдыхании оставляет сладковатый привкус. При изменении температуры он переходит в другое агрегатное состояние:
- При повышении до 151.8°C — становится жидким.
- Понижение до -163.7°C сделает его твердым.
Это несолеобразующий оксид. Для этого вещества характерны только реакции присоединения — хорошо «сливается» с хлором и кислородом:
2NO + Cl2 → 2NOCL (нитрозилхлорид — газ красного цвета, очень токсичный, имеет резкий, удушливый запах);
2NO + O2 → 2NO2.
Этот монооксид кислород практически не отдает, поэтому в его атмосфере реакции горения происходят только с теми веществами, которые очень «энергично» сливаются с кислородом (например, фосфор).
Получают NO каталитическим окислением аммиака в присутствии катализатора (промышленный способ). Ранее его «доставали» при продувке воздуха через электрическую дугу. Но сейчас этот способ устарел — при нем образуется лишь малое количество нужной смеси.
В лабораториях NO получают путем воздействия на медь слабого раствора азотной кислоты:
3Cu + 8HNO3 → 3Cu (NO3)2 + 2NO + 4H2O.
Примечание: в небольших дозах монооксид образуется при грозовых разрядах.
Бурый газ («лисий хвост») — NO2
Газ с характерным запахом, тяжелее воздуха, легко сжижается. Имеет характерную окраску — рыжий цвет. Причем чем выше будет окружающая температура, тем более ярким окажется оттенок соединения.
Это солеобразующий оксид. При растворении в воде образует азотную и азотистую кислоты:
2NO2 + H2O → HNO3 (азотная кислота) + HNO2 (азотистая кислота).
При взаимодействии со щелочами он образует соли этих двух кислот:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O.
В промышленности NO2 получают при окислении монооксида азота (NO):
2NO + O2 → 2NO2.
В лабораторных условиях его получают при реакции воздействия концентрированной азотной кислоты на металлы и неметаллы, а также разложением нитратов:
- Cu + 4HNO3 → Cu (NO3)2 + 2NO2 + H2O;
- S + 6HNO3 → H2SO4 + 6NO2 + 2H2O;
- 2Pb (NO3)2 → 2PbO + 4NO2 + O2.
Диоксид азота применяется для получения азотной кислоты.
NO2 часто является побочным продуктом многих химических производств. Именно он дает «ржавую» окраску (благодаря которой его и прозвали «лисий хвост») выбросам, попадающим в атмосферу из заводских труб. Улетучиваясь в воздух, этот газ представляет серьезную опасность для окружающей среды — например, он вызывает кислотные дожди. При этом, соединяясь с водой, он еще является и сильным коррозионным агентом. Кроме того, для человека эти «выхлопы» тоже вредны, так как приводят к раздражению слизистых оболочек, изменению состава крови (понижается уровень гемоглобина).
Азотистый ангидрид N2O3
Это жидкость, окрашенная в темно-синий цвет. В нормальных условиях соединение неустойчиво (температура кипения всего 3,5°C), и разлагается на монооксид (NO) и диоксид (NO2). При охлаждении до -102°C становится твердым.
При взаимодействии с водой образует азотистую кислоту, которая, в свою очередь, распадается на монооксид и азотную кислоту (HNO3):
- N2O3 + H2O → 2HNO2;
- 3HNO2 → HNO3 + 2NO + H2O (реакция идет при нагревании).
В реакциях со щелочами образуются соли азотистой кислоты:
N2O3 + 2NaOH → 2NaNO2 + H2O.
Получают азотистый ангидрид при охлаждении смеси монооксида и диоксида:
NO + NO2 → N2O3.
Примечание: азотистый ангидрид — промежуточный продукт, получаемый в производстве серной кислоты нитрозным способом. Сам же N2O3 никакого практического применения не имеет.
N2O5 — высший оксид
Пентаоксид диазота (или азотный ангидрид) — белое кристаллическое вещество, очень нестойкое (плавится при температуре 32,3°C). Какие химические реакции для него характерны:
- Реакция взаимодействия с водой: N2O5 + H2O → 2HNO3.
- Взаимодействие со щелочами: N2O5 + 2NaOH → 2NaNO3 + H2O.
- Взаимодействие с перекисью водорода (H2O2) — результатом этой реакции станет образование HNO4 (надазотная кислота). Но этот процесс должен проводиться при низких температурах (-80°C).
- Реакция разложения (часто протекает со взрывом): 2N2O5 → 4NO2 + O2.
Получают азотный ангидрид путем воздействия на безводную азотную кислоту, или же реакцией взаимодействия озона на NO2:
- 2HNO3 + P2O5 → N2O5 + 2HPO3 (метафосфорная кислота) — реакция проводится под воздействием температуры;
- 2NO2 + O3 → N2O5 + O2.
Азотный ангидрид — очень сильный окислитель, он бурно вступает в реакции со многими органическими соединениями. Однако практического применения это соединение не находит.