Содержание
Атом водорода и электроотрицательные частицы тесно взаимосвязаны между собой ковалентным способом. Это называется водородная химическая связь, в которой в качестве мелких электроотрицательных частиц чаще всего выступают N, O или F. Они, как правило, бывают межмолекулярными и внутримолекулярными.
Коротко о природе
Чаще всего такие отношения рассматриваются как электростатическое взаимодействие, которое усиливает небольшой размер водорода. В результате между взаимодействующими диполями возможна близость.
По сути, это разновидность донорно-акцепторных взаимоотношений между водородными молекулами и электроотрицательными элементами. Итог таких взаимосвязей — появление комплексов различной степени стабильности. Особенности ковалентных отношений:
- Высокая прочность.
- Распространенность в органических соединениях.
- Дополнительных связующих электронов у Н2 не существуют.
Сегодня в рамках теории молекулярных орбиталей подобный тип связи считается одним из частных случаев ковалентности. Он сопровождается делокализацией электронной плотности по атомной цепочке. В результате образуются трехцентровые четырехэлектронные ассоциации.
Основные подтипы
Водородную связь подразделяют на межмолекулярную и внутримолекулярную. У них следующие особенности:
- Первая возникает между молекулами, являющимися однотипными.
- Вторая появляется внутри одного элемента.
Способ возникновения взаимосвязей в обоих подтипах одинаковый. С их помощью появляется молекулярная цепочка. При этом водород сцепляется с остальными частицами.
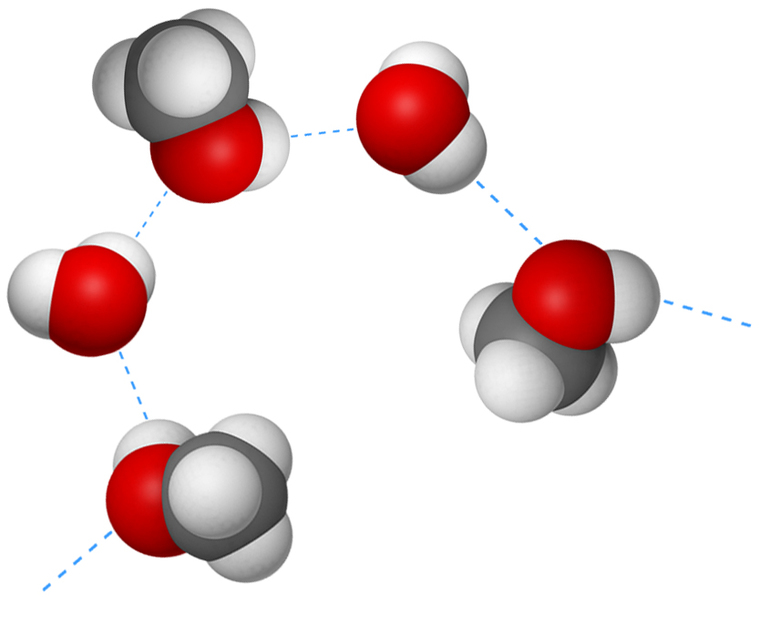
К примеру, H2O образована за счет кислорода и H2. Благодаря высокому уровню электроотрицательности O2, притягиваются электроны остальных атомов, а сам он окисляется и превращается в свободный. Водородные орбитали освобождаются.
Прочие аналогичные составляющие присоединяются на место электронных пар и заполняют освободившиеся ячейки. Именно так начинаются межмолекулярные водородные отношения.
Аналогично соединяются компоненты плавиковой кислоты. Вот только связь будет немного слабее. За счет большей электроотрицательности сила притяжения увеличивается.
Внутримолекулярная взаимосвязь возникает у сложных органических веществ, какими являются белки, ДНК. У салициловой кислоты она образуется между имеющимися гидроксильными группами.
Механизм образования
Схема возникновения смешанная — одновременно электростатическая и донорно-акцепторная. Решающую роль играет повышение уровня отрицательного заряда одной из частиц, за счет чего оттягивается электронная пара другой.
В итоге первая приобретает частично отрицательную заряженность, а вторая — положительную. А также происходит поляризация. Образовавшиеся катионы притягивают анионы. В результате появляются H-связи. Для их формирования необходимы донор и акцептор (протон и водород).
Донорство между ними, никогда не осуществляется в обычных условиях на 100%. Все составляющие химически связаны с H2. Это обозначается графически в виде линии из нескольких точек: указывается что такое взаимодействие намного слабее, чем ковалентное.
Только 3 элемента полностью проявляют донорские способности. Это азот, кислород и фтор. В них образуются Н-взаимосвязи. Низкомолекулярным соединениям, таким образом, придается способность иметь жидкое агрегатное состояние (как пропен и метанол).
Могут такие вещества и превращаться в газы, какие сильно сжижаются в случае охлаждения. Здесь химики приводят в качестве характерного примера аммиак и гидрофторит.
Проявление в органической химии
Рассматриваемый тип взаимодействия возможен в неорганике (у HCl и прочих кислот) и в органике. Он возникает при воздействии друг на друга кислотных групп, принадлежащих к молекулам, обладающих как похожими, так и разными физическими и химическими свойствами.
При объединении похожих элементов образуются ассоциаты, а различных — молекулярные комплексы. Последние составляют самый обширный тип взаимосвязей, называемых водородными. В результате таких реакций образуются бинарные комплексы.
Помимо этого, нередко появляются цепи, кольца и пространственные сетки. Аналогичные образования возможны и в кристаллах.
Водородная связь возникает между атомами водорода и электроотрицательными частицами. Она возможна у органических и неорганических веществ.